Hoje falaremos sobre um grupo de aços muito utilizado na indústria automobilística: os aços com efeito TRIP (plasticidade induzida por transformação de fases). Estes materiais estão inseridos na família de aços AHSS (aços avançados de alta resistência), os quais oferecem uma elevada resistência mecânica, necessária para diminuir o peso dos veículos na indústria automobilística, enquanto mantém elevada a conformabilidade do material, fator tão importante para a produção dos componentes estruturais. Além dos aços TRIP, são parte desta família os aços dual phase, martensíticos, complex phase e ferrítico-bainíticos.
Os aços TRIP apresentam matriz ferrítica com dispersão das fases bainita e austenita retida, sendo esta última a responsável pela modificação das propriedades do aço na medida em que este sofre deformação plástica. Em outras palavras, a plasticidade induzida por transformação de fases presente nestes aços é consequência da transformação de austenita retida em martensita, que é proporcional à deformação plástica sofrida pelo material. Assim, consegue-se um aço otimizado, que apresenta diferentes microconstituintes de acordo com o que é exigido do mesmo. Desta forma, o material é conformado quando apresenta um microconstituinte cúbico de faces centradas (CFC), a austenita, que é bastante dúctil por apresentar muitos planos de escorregamento para as discordâncias, facilitando a conformação. Em seguida, introduzindo deformação plástica, a resistência do material em serviço é aumentada consideravelmente através da transformação desta austenita metaestável em martensita, tornando o aço capaz de suportar um maior esforço.
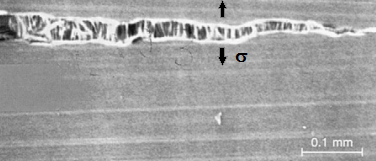
O funcionamento deste mecanismo pode ser melhor explicado a partir da figura abaixo, de um corpo de prova submetido a ensaio de tração.
Corpo de prova apresentando estricção em ensaio de tração.
Verifica-se que após a estricção no ensaio de tração, esta nova região formada, de menor seção transversal resistente, será a região mais solicitada e local da futura ruptura do material. No entanto, se você for pensar no aço TRIP submetido a essas condições de ensaio, verificará que esta região da estricção, por apresentar maior grau de deformação, será também aquela em que haverá uma maior concentração de martensita. Assim, esta região apresentará resistência comparável às demais e a deformação voltará a ser mais bem distribuída ao longo do corpo de prova, que consequentemente irá apresentar uma maior taxa de encruamento e maior alongamento no ensaio de tração. Na indústria automobilística, portanto, este material também terá a vantagem de no caso de eventual colisão do veículo, absorver uma quantidade elevada de energia. Além, é claro, da vantagem associada à fácil conformabilidade.
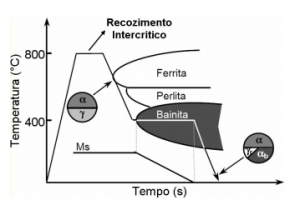
Quanto à produção dos aços TRIP, é necessário um tratamento térmico que apresenta duas etapas. Primeiramente, o metal é aquecido e permanece um tempo no intervalo de temperatura de 780 a 880 °C, ou seja, sofre um recozimento intercrítico. Uma vez obtida a microestrutura austenítica, inicia-se o resfriamento controlado do aço para a formação de ferrita e bainita. A ferrita é formada primeiro, por meio de um resfriamento contínuo, e em seguida é formada a bainita ao manter-se o material em condição isotérmica, a 400°C. A quantidade de bainita formada é controlada e o tratamento é interrompido antes que a transformação bainítica possa ser concluída. Assim, assegura-se que ao resfriar o material ao ar, parte da austenita inicial seja mantida na microestrutura. Esta austenita será denominada de austenita retida e estará em condição metaestável, transformando-se em martensita à medida que o material for sendo deformado plasticamente.
O tratamento pode ser resumido pelo esquema abaixo:
Tratamento térmico de aço TRIP após ser submetido a laminação à frio. Fonte: NIGRI,2008.
Você pode estar se perguntando por que razão o aço precisa apresentar estes 3 microconstituintes. Isto se deve ao fato de que o aço TRIP não garante suas propriedades mecânicas apenas com a transformação martensítica induzida por deformação, mas também por endurecimento por solução sólida, refino de grão, endurecimento por precipitação e presença simultânea de fases duras e macias em sua microestrutura. Para isso, utilizam-se elementos de liga, tais como Mn e P (endurecimento por solução sólida), Si e Cu (endurecimento por solução sólida e precipitação) e Nb (refino de grão) unidos às fases ferrita, bainita e austenita retida, de diferentes durezas. Na realidade, ainda não se conhece quais as contribuições exatas de cada fase no comportamento mecânico do aço, provavelmente devido à quantidade de fatores envolvidos na melhoria deste tipo de propriedade.
Referências:
EMADODDIN, E.; AKBARZADEH, A.; DANESHI, G. H. Effect of intercritical annealing on retained austenite characterization in textured TRIP-assisted steel sheet. Materials characterization, v. 57, n. 4, p. 408-413, 2006.
UTHAISANGSUK, V.; PRAHL, U.; BLECK, W. Micromechanical modelling of damage behaviour of multiphase steels. Computational Materials Science, v. 43, n. 1, p. 27-35, 2008.
GIRAULT, Etienne et al. Study of the temperature dependence of the bainitic transformation rate in a multiphase TRIP-assisted steel. Materials Science and Engineering: A, v. 273, p. 471-474, 1999.
NIGRI, E. Estudo Exploratório da Soldagem por Fricção e Mistura Mecânica de um Aço TRIP 800. 2008. 130 f. Dissertação (Mestrado em Engenharia Metalúrgica) – PPG em Engenharia Metalúrgica, Pontifícia Universidade Católica do Rio de Janeiro, Rio de Janeiro, 2008.