Olá galera,
O tema de hoje é alotropia, ou seja, a capacidade de um elemento químico formar diferentes substâncias simples. Essas substâncias, denominadas formas alotrópicas, diferem-se entre si no que diz respeito a suas estruturas cristalinas ou atomicidade e, por causa desses fatores que podem parecer apenas detalhes, as características e propriedades das substâncias em questão podem ser tornar completamente diferentes.
Um exemplo de elemento químico que sofre alotropia é o estanho: Ele pode se organizar em uma estrutura tetragonal de corpo centrado (imagem à esquerda), denominado estanho branco ou em uma estrutura cúbica semelhante à do diamante (imagem à direita), caracterizando o estanho cinza.
Estruturas cristalinas das formas alotrópicas do estanho. Adaptado de: Os alótropos do estanho.
A transformação de estanho branco em cinza leva a uma expansão no volume em aproximadamente 27%, culminando na desintegração do material. Apesar de a temperatura de transição ser 13,2°C, a transformação de forma alotrópica acontece a uma taxa muito lenta em condições normais de temperatura, então o fenômeno pode de certa forma ser desprezado. No entanto, a utilização de estanho em regiões de frio extremo pode ter resultados dramáticos, caso sua transformação alotrópica não seja lembrada, como aconteceu em 1812 na Rússia. Naquele ano, houve um inverno bastante rigoroso, com um período longo de temperaturas bastante baixas, assim a taxa de transformação de estanho branco em estanho cinza, mais estável em temperaturas abaixo de 13,2°C do que a primeira substância, foi rápida o suficiente para que seus efeitos pudessem ser sentidos. As consequências? Durante o inverno daquele ano aconteciam as invasões Napoleônicas na Rússia e exatamente no período em que os soldados deveriam estar mais agasalhados, os botões de seus uniformes esfarelaram-se e desfizeram-se em pedaços. Há historiadores que dizem que este foi um dos principais motivos a contribuir para a derrota de Napoleão Bonaparte. Além disso alguns tubos de órgãos de igrejas também foram destruídos por essa transformação. Devido a esses casos, a transição alotrópica do estanho chegou a inclusive ser batizada como “doença do estanho”.
Estanho branco (acima) e estanho cinza (abaixo). Fonte: CALLISTER
Outro elemento que possui alotropia é o ferro, o qual é o principal elemento a compor o aço, um dos materiais mais utilizados no meio industrial, construção civil e mais presentes no dia-a-dia dos engenheiros de materiais. Portanto, conhecer as transformações alotrópicas do ferro e saber explorá-las é de extrema importância.
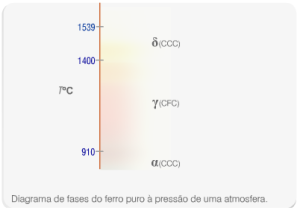
Primeiramente, as transformações alotrópicas do ferro ocorrem a temperaturas muito superiores à temperatura ambiente (910°C e 1400°C), de forma com que devam ser compreendidas não para evitar problemas, como no caso do estanho, mas sim para compreender como processar o material de forma a atingir as propriedades que lhe são requisitadas.
Fases alotrópicas do ferro e suas temperaturas de estabilidade. Fonte: Ciência dos Materiais
A partir da Figura acima, verifica-se que a temperaturas abaixo de 910°C, o ferro apresenta estrutura cristalina cúbica de corpo centrado (CCC), denominado ferro α. Acima dessa temperatura, ocorre a transição para uma fase γ de estrutura cúbica de faces centradas (CFC), alterando o comportamento do ferro. Continuando o aquecimento do ferro γ, atinge-se uma temperatura (1400°C) na qual esta deixa de ser a fase mais estável termodinamicamente, dando lugar ao ferro δ, que é estável até 1539°C, temperatura na qual torna-se líquido. A transição mais estudada e de maior importância é a de ferro α para γ. Analisando-se as características de cada uma dessas fases, constatou-se que o ferro γ apresenta uma solubilidade muito maior de carbono do que o α. A partir desse conhecimento, pensou-se em utilizar o ferro γ para fazer aços com maiores teores de carbono, pois seria possível dissolver esse elemento em quantidades superiores ao que seria possível em ferro α. Você pode estar se perguntando, por que dissolver carbono no ferro γ se ao resfriar o material à temperatura ambiente esse carbono não será mais solúvel na fase α e vai se precipitar no ferro? Na verdade esse resfriamento até a temperatura ambiente é feito de maneira bastante rápida e, dessa forma, o carbono continua dissolvido na matriz, pois não tem tempo de sair dos interstícios da rede composta por átomos de ferro. O resultado é um aço com novas propriedades, por exemplo maior resistência mecânica e dureza e que possui uma rede cúbica de corpo centrado distorcida pela presença de uma quantidade excessiva de carbono, a chamada estrutura tetragonal de corpo centrado (TCC). Esse aço é denominado de martensítico.
Estruturas cristalinas CCC, CFC e TCC, respectivamente. Adaptado de: Princípios de Tratamentos Térmicos em Aços e Ferros Fundidos.
Outras propriedades que merecem destaque na austenita (ferro γ + carbono), é que possui menor dureza em relação à ferrita (ferro α + carbono), apresenta grande resistência ao desgaste, é magnética, e é o constituinte mais denso dos aços. Caso deseje-se um material com alguma dessas características, é possível fazer algo para manter a austenita mais estável do que a ferrita à temperatura ambiente? Sim! Por meio da adição de elementos de liga, por exemplo, os quais podem mudar a temperatura de transição de fases para uma temperatura superior ou inferior à original, favorecendo a formação de um tipo de fase ou de outro em uma determinada temperatura. O próprio carbono dos aços abaixa essa temperatura de transição α-γ de 910°C para aproximadamente 723°C.
A partir dos casos mencionados, verifica-se que um bom engenheiro de materiais deve conhecer um pouco sobre a alotropia dos elementos químicos com que trabalha para poder explorar suas propriedades ou prever possíveis desastres. Os elementos estanho e ferro foram selecionados para esse post por entender-se que teriam maior impacto no âmbito da engenharia de materiais, no entanto elementos como carbono, enxofre, fósforo e oxigênio também sofrem alotropia e fica como sugestão a leitura sobre esses casos.
Fontes:
CALLISTER, William D. Ciência e engenharia de materiais: uma introdução. 7. ed. Rio de Janeiro: LTC, c2008. xx, 705 p.;



Parabens Pelo seu Artigo muito bom Gostei