A corrosão é definida pela NACE (National Association of Corrosion Engineers – importante associação da área) como a deterioração de um material, geralmente metálico, que resulta de uma reação com o meio em que este se encontra. A corrosão pode ser química ou eletrolítica. Algumas das inúmeras diferenças entre estas duas classes são listadas na Tabela abaixo:

Principais diferenças entre corrosão eletroquímica e química.
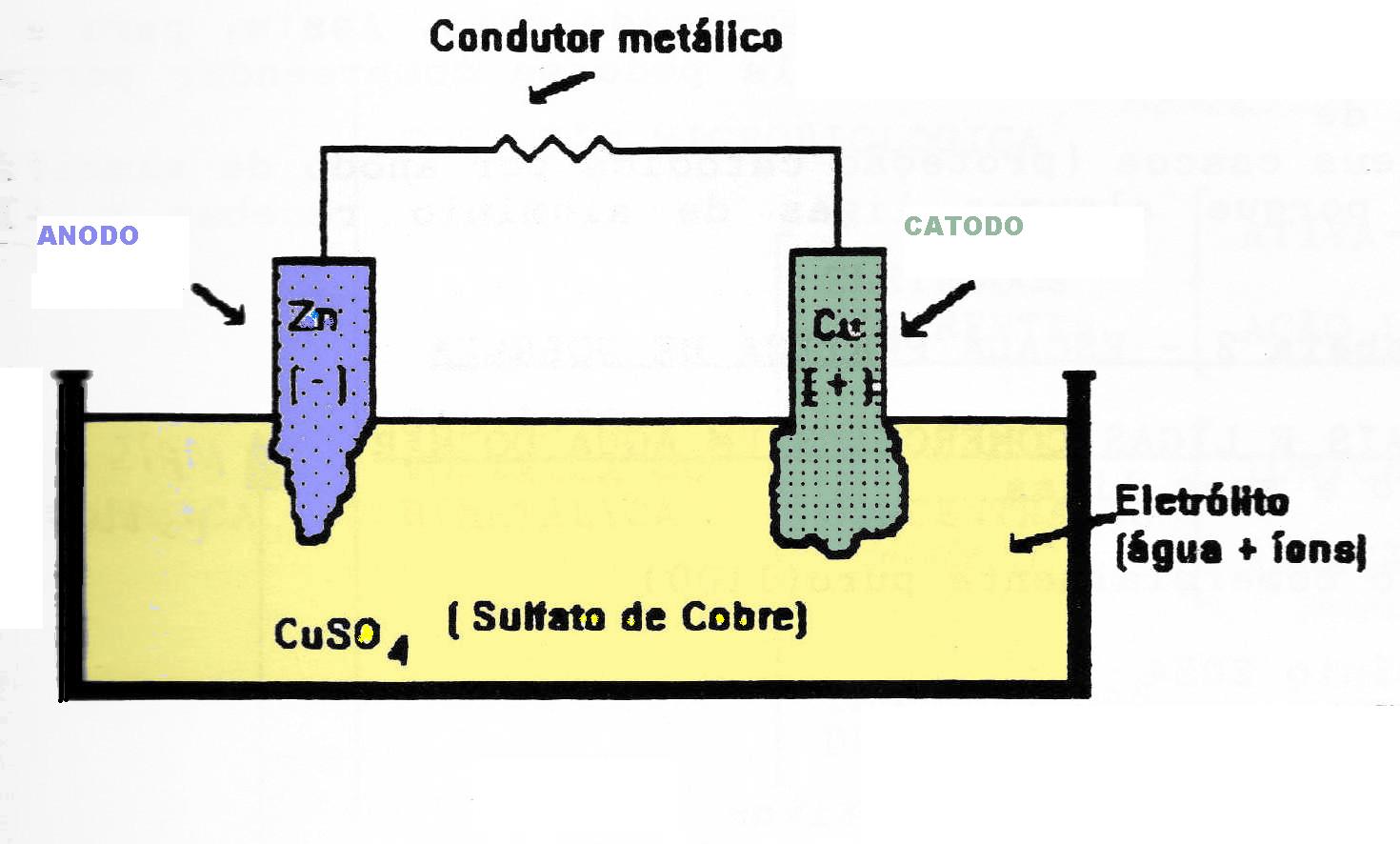
A corrosão eletroquímica será o foco da publicação de hoje, visto que é a mais frequente na natureza. Para que haja a ocorrência de corrosão eletroquímica, é necessária a transferência de elétrons, isto é, a ocorrência de reações de oxirredução. Este tipo de corrosão desencadeia-se através da formação de uma pilha de corrosão eletroquímica, a qual contém obrigatoriamente quatro elementos:
- Ânodo: Região em que ocorrem as reações de oxidação. Consequentemente, é a superfície na qual a corrosão ocorre.
- Cátodo: Região em que ocorrem as reações de redução. Assim, a superfície torna-se protegida, não há corrosão.
- Eletrólito: Solução condutora que envolve o cátodo e o ânodo.
- Ligação elétrica entre cátodo e ânodo
O exemplo clássico das pilhas de corrosão eletroquímicas são as pilhas galvânicas, aquelas formadas entre dois metais diferentes, que costumamos estudar no ensino médio. Este tipo de pilha é ilustrado pela figura abaixo, representando os quatro elementos obrigatórios para a ocorrência das reações de oxirredução.
Pilha galvânica. Fonte
A pilha de corrosão galvânica ocorre devido à diferença de potencial de eletrodo entre os diferentes metais, e é mais reativa quanto maior for esta diferença de potencial. Para prever qual metal será corroído e qual será reduzido, existem algumas tabelas práticas. A mais famosa delas é a tabela de potenciais de eletrodos padrão, para a qual foi convencionada a reação de redução do hidrogênio (2H+ + 2e- -> H2) como um potencial de valor zero. A partir de análise comparativa da tendência de outros metais em sofrerem redução, em relação ao hidrogênio, criou-se uma tabela que permite comparar todos eles e prever qual será mais “nobre”, termo utilizado quando um metal tem menor tendência a sofrer corrosão em relação a outro.

Tabela de potenciais de eletrodos padrão. Fonte
A limitação deste tipo de tabela é que ela foi construída para um determinado metal imerso em uma solução iônica em que os cátions são de mesma composição que o metal, por exemplo, o alumínio foi imerso em uma solução contendo Al3+, o lítio em uma solução de Li+ e assim por diante. Isto nem sempre é encontrado na natureza, tornando a tabela limitada. Para isso, existem tabelas avaliando a redução dos metais em ambientes que simulam o ambiente real em que estes se encontram, por exemplo a água do mar:

Tendência de diferentes metais a sofrer corrosão em água do mar. Fonte
A formação de pilhas galvânicas é apenas uma das maneiras através da qual pode ser desencadeada a corrosão eletrolítica. Além destas, podem ocorrer por exemplo a formação de pilhas de ação local, ativo-passiva, concentração iônica diferencial ou aeração diferencial. Vejamos resumidamente como cada uma delas funciona:
- Pilha de ação local: É causada em um mesmo metal devido a heterogeneidades em sua composição química, textura ou mesmo em suas tensões internas de uma região para outra. Assim, qualquer diferença no material, sejam poros, inclusões, trincas, diferentes estados de tensão, acabamento superficial ruim, diferença nos tamanhos de grão, tratamentos térmicos diferentes, materiais de épocas diferentes, entre outros, irá desencadear um processo de corrosão eletrolítica. Por esta razão, este tipo de pilha é o mais frequente na natureza.
- Pilha ativo-passiva: Ocorre em materiais que formam películas apassivadoras, aquelas que são formadas por um processo corrosivo mas que tem ação protetora, recobrindo a superfície de um material metálico e impedindo que o processo corrosivo tenha continuidade. Como o material está protegido, se houver por alguma razão um dano na película em alguma região da superfície, esta região será extremamente suscetível à corrosão. Isto ocorrerá porque se formará uma pequena região anódica em meio à uma imensa região catódica, levando à primeira a uma forte corrosão localizada, característica das pilhas ativo-passivas.
- Pilhas de concentração e de aeração diferencial: Ocorrem respectivamente em condições em que um metal é exposto a diferentes concentrações de seus próprios íons ou de oxigênio. A região mais concentrada em íons será protegida, enquanto a menos concentrada sofrerá corrosão. De forma semelhante, para o gás oxigênio também ficará protegida a região mais aerada e será atacada aquela com menor teor de oxigênio.
Considerando a possibilidade quase certa de um metal apresentar uma ou mais dessas condições que favorecem o processo corrosivo, é possível compreender porque afinal estes materiais são tão suscetíveis à corrosão.
Bom dia, meninas.
Adorei a explicação sobre corrosão eletroquímica. Porém, não compreendi as setas ao lado da tabela de potenciais de eletrodo padrão. A seta da esquerda (vermelha) não deveria ser “AUMENTA O CARATÉR OXIDANTE” de baixo para cima, e a seta da direita (azul) não deveria ser “AUMENTA O CARATÉR REDUTOR” de cima para baixo? Não sou da área de química, estou perguntando porque não entendi mesmo. Ou melhor, eu entendi de forma contrária.
Fico no aguardo.
Att,
Vânia.
Olá Vânia,
Muito obrigada pela sua pergunta.
As setas estão corretas, pois quando é dito que aumenta o caráter redutor, quer dizer que quanto mais acima, mais tendência o material terá de se oxidar. O material que se oxida é chamado de agente redutor, já que ele vai reduzir o outro material. Assim como o material que se reduz é chamado de agente oxidante. Por isso na tabela está descrito nessa forma.
O que importa é que, pelo o que eu vi, seu raciocínio está correto: Quanto mais para baixo da tabela o metal estiver, mais nobre ele será, então menor a tendência de ele se oxidar quando na presença de outro metal.
Caso você possua alguma dúvida, fique à vontade para perguntar.
Att.,
Viviane